Proučavanje spektra atoma vodika. Proučavanje spektra atoma vodika i natrija. Prijelazi između visoko pobuđenih stanja
Pošaljite svoj dobar rad u bazu znanja jednostavno je. Koristite obrazac u nastavku
Studenti, diplomanti, mladi znanstvenici koji koriste bazu znanja u svom studiju i radu bit će vam vrlo zahvalni.
LABORATORIJAPOSAO
PROUČAVANJE SPEKTRA VODIKOVOG ATOMA
1. CILJDJELA
1.1 Proučite spektar atomskog vodika u vidljivom području spektra i izmjerite valne duljine vodikovih linija N b, N V, N G, N d .
1.2 Izračunajte vrijednost Rydbergove konstante.
1.3 Prema pronađenoj vrijednosti R izračunati Planckovu konstantu h.
2. RANGEVODIKIENERGIJARAZINE
2.1 EksperimentiRutherford.Strukturaatom
Objavljeno na http://www.allbest.ru/
Godine 1910. Rutherford i njegovi suradnici proveli su niz eksperimenata kako bi promatrali raspršenje alfa čestica dok su prolazile kroz tanku metalnu foliju. Eksperiment je proveden na sljedeći način (slika 1). Snop alfa čestica koje emitira radioaktivni izvor ispušten kroz usku rupu u spremniku I, pao je na tanku metalnu foliju F. Pri prolasku kroz foliju alfa čestice su pod različitim kutovima odstupale od svog izvornog smjera gibanja. Raspršene alfa čestice udaraju u zaslon E, obložene cinkovim sulfidom, a scintilacije (bljeskovi svjetlosti) koje su izazvale promatrane su pod mikroskopom M. Mikroskop i zaslon mogli su se okretati oko osi koja prolazi kroz središte folije i tako postaviti pod bilo kojim kutom. Cijeli aparat je smješten u vakuumsku komoru kako bi se eliminiralo raspršenje alfa čestica sudarom s molekulama zraka.
Promatranja su pokazala da većina alfa-čestica odstupa od izvornog smjera samo za male kutove, ali u isto vrijeme, kut raspršenja malog broja alfa-čestica pokazuje se značajno velikim i može doseći čak 180 o. Nakon analize rezultata eksperimenta, Rutherford je došao do zaključka da je tako jako odstupanje alfa čestica od izvornog smjera moguće samo ako unutar atoma postoji izuzetno jako električno polje, koje stvara naboj povezan s velikim masa. Mali udio čestica raspršenih pod velikim kutovima ukazuje na to da su pozitivni naboj i povezana masa koncentrirani u vrlo malom volumenu i da je vjerojatnost izravnog pogotka mala. Na temelju tog zaključka Rutherford je 1911. predložio nuklearni model atoma. Prema Rutherfordu, atom je sustav naboja, u čijem se središtu nalazi teška pozitivno nabijena jezgra, čija dimenzija ne prelazi 10 -12 cm, a negativno nabijeni elektroni rotiraju oko jezgre (kako ne bi pali na jezgru). jezgra), čiji je ukupni naboj po veličini jednak naboju jezgre. Gotovo sva masa atoma koncentrirana je u jezgri.
No pokazalo se da je nuklearni model u suprotnosti sa zakonima klasične mehanike i elektrodinamike. Suština kontradikcije je sljedeća: elektron, koji se kreće duž zakrivljene staze, mora imati centripetalno ubrzanje. Prema zakonima klasične elektrodinamike, naboj koji se kreće ubrzano mora kontinuirano emitirati elektromagnetske valove. Proces zračenja popraćen je gubitkom energije, tako da bi se elektron (ako slijedite klasične zakone) trebao postupno spuštati, krećući se u spirali i, u konačnici, pasti na jezgru. Procjene su pokazale da bi vrijeme nakon kojeg elektron mora pasti na jezgru trebalo biti približno 10 -8 s. Istodobno, neprestano mijenjajući radijus svoje orbite, trebao bi emitirati kontinuirani spektar, dok je u pokusima s razrijeđenim plinovima utvrđeno da su spektri atoma iscrtani. Tako se pojavila kontradikcija između ideja o atomu proizašlih iz rezultata Rutherfordovih eksperimenata i zakona klasične fizike, prema kojima atom koji ima naznačenu strukturu mora biti nestabilan, a njegov spektar zračenja mora biti kontinuiran.
2.2 PostulatiBura.OsnovnoBorovskajateorijavodikdnogoatom
Izlaz iz proturječja koje se pojavilo između zakona klasične fizike i zaključaka proizašlih iz rezultata Rutherfordovih eksperimenata predložio je Niels Bohr, koji je 1913. godine formulirao sljedeće postavke: Postulat – izjava prihvaćena bez dokaza, kao aksiom. Valjanost pojedinog postulata može se prosuditi usporedbom rezultata dobivenih korištenjem pojedinog postulata s eksperimentom. :
1) Od beskonačnog broja elektronskih orbita mogućih za elektron u atomu sa stajališta klasične mehanike, samo nekoliko, tzv. stacionarni. Dok na stacionarni orbita elektron Ne emitira energije (Em valovi) Iako I kreće se S ubrzanje. Za stacionarnu orbitu, kutna količina gibanja elektrona mora biti cijeli višekratnik konstantne vrijednosti
(-Diracova konstanta).
Oni. mora biti zadovoljen sljedeći omjer:
Gdje m e- masa elektrona, v- brzina elektrona, r - polumjer orbite elektrona, n- cijeli broj koji može poprimiti vrijednosti 1, 2, 3, 4... i naziva se glavni kvantni broj.
2) Zračenje emitira ili apsorbira atom u obliku svjetlosnog kvanta energije tijekom prijelaza elektrona iz jednog stacionarnog (stabilnog) stanja u drugo. Veličina kvanta svjetlosti jednaka je razlici energija tih stacionarnih stanja E n 1 I E n 2 , između kojih dolazi do kvantnog skoka elektrona:
Isti odnos vrijedi i za slučaj apsorpcije. Odnos (2) naziva se PravilofrekvencijeBura.
2.3 ModelBuraatomvodik
Bohr je model vodikovog atoma temeljio na planetarnom modelu Rutherfordovog atoma i već spomenutim postulatima. Iz prvog Bohrovog postulata slijedi da su moguće samo takve orbite gibanja elektrona oko jezgre kod kojih je kutna količina gibanja elektrona jednaka cijelom umnošku Diracove konstante (vidi (1)). Bohr je tada primijenio zakone klasične fizike. U skladu s drugim Newtonovim zakonom, za elektron koji rotira oko jezgre, Coulombova sila ima ulogu centripetalne sile i mora biti zadovoljen sljedeći odnos:
isključujući brzinu iz jednadžbi (1) i (3), dobiven je izraz za polumjere dopuštenih orbita:
Ovdje n - glavni kvantni broj ( n = 1,2,3…
Polumjer prve orbite atoma vodika naziva se Borovskizbognasom i jednaka je
Unutarnja energija atoma jednaka je zbroju kinetičke energije elektrona i potencijalne energije međudjelovanja između elektrona i jezgre (jezgra se zbog svoje velike mase u prvoj aproksimaciji smatra nepomičnom) .
Tako kao (vidi formulu (3))
Zamjenom u (6) izraza r n iz (4) nalazimo dopuštene vrijednosti unutarnje energije atoma:
Gdje n = 1, 2, 3, 4…
Pri prijelazu atoma vodika iz stanja n 1 u stanju n 2 emitira se foton.
Inverzna valna duljina emitirane svjetlosti može se izračunati pomoću formule:
2.4 ObrasciVatomskispektri
Provodeći eksperimentalna istraživanja emisijskih spektara vodika, Balmer je otkrio da atomi vodika (kao i atomi drugih elemenata) emitiraju elektromagnetske valove strogo definiranih frekvencija. Štoviše, pokazalo se da se recipročna vrijednost valne duljine spektralne linije može izračunati kao razlika nekih dviju veličina, koje se nazivaju spektralni članovi, tj. vrijedi sljedeći omjer:
Kvantitativna obrada eksperimentalno dobivenih vodikovih spektara pokazala je da se članovi mogu napisati na sljedeći način:
Gdje R je Rydbergova konstanta, a n je cijeli broj koji može poprimiti niz cijelih vrijednosti 1,2,3... Eksperimentalno dobivena vrijednost Rydbergove konstante bila je:
Uzimajući u obzir gore navedeno, valna duljina bilo koje spektralne linije vodika može se izračunati iz generaliziraniformulaBalmera:
gdje su brojevi n 1 I n 2 može uzeti vrijednosti: n 1 = 1,2,3...; n 2 = n 1 , n 1 +1, n 1 +2 …
Valne duljine izračunate pomoću formule (15) vrlo su se točno poklapale s eksperimentalno izmjerenim valnim duljinama u spektru emisije vodika.
Uspoređujući formule (11) i (15), možemo zaključiti da je formula (11) ista generalizirana Balmerova formula, ali dobivena teorijski. Stoga se vrijednost Rydbergove konstante može izračunati pomoću formule:
Brojke n 1 , n 2 - to su kvantni brojevi, a to su brojevi stacionarnih orbita između kojih dolazi do kvantnog skoka elektrona. Ako eksperimentalno mjerite vrijednost Rydbergove konstante, tada pomoću relacije (16) možete izračunati Planckovu konstantu h.
atomski vodik bor rydberg
3. METODOLOGIJAIZVOĐENJEDJELA
3.1 Radniciformule
Rasponradijacija je važna karakteristika tvari, koja omogućuje utvrđivanje njezina sastava, nekih karakteristika njezine strukture te svojstava atoma i molekula.
Plinovi u atomskom stanju emitiraju linijske spektre, koji se mogu podijeliti na spektralni niz.Spektralni niz je skup spektralnih linija za koje kvantni broj n 1 (broj razine na koju se prelaze sa svih viših razina) ima isto značenje. Najjednostavniji spektar je spektar atoma vodika. Valne duljine njegovih spektralnih linija određene su Balmerovom formulom (15) ili (11).
Svaka serija spektra atoma vodika ima svoju specifičnu vrijednost. n 1 . Vrijednosti n 2 predstavljaju sekvencijalni niz cijelih brojeva iz n 1 +1 za?. Broj n 1 predstavlja broj energetske razine atoma na koju prelazi elektron nakon zračenja; n 2 - broj razine s koje prelazi elektron kada atom emitira elektromagnetsku energiju.
Prema formuli (15 ), Spektar emisije vodika može se prikazati u obliku sljedeće serije (vidi sliku 2):
Niz Lyman (n 1 =1) - ultraljubičasti dio spektra:
Niz Balmera (n 1 = 2) - vidljivi dio spektra:
Slika 2. Niz spektra atoma vodika
a) energetski dijagram, b) prijelazni dijagram, c) skala valnih duljina.
Niz pašen (n 1 = 3) - infracrveni dio spektra:
Niz Zagrada (n 1 = 4) - infracrveni dio spektra:
Niz Pfunda(n 1 = 5) - infracrveni dio spektra:
U ovom radu proučavamo prva četiri retka Balmerovog niza, koji odgovaraju prijelazima na razinu n 1 = 2. Veličina n 2 za prve četiri linije ove serije, koje leže u vidljivom području, uzimaju vrijednosti 3, 4, 5, 6. Ove linije imaju sljedeće oznake:
H b- Crvena crta ( n 2 = 3),
H V- zeleno-plava ( n 2 = 4),
H n- plava ( n 2 = 5),
H d- ljubičasta ( n 2 = 6).
Eksperimentalno određivanje Rydbergove konstante pomoću linija Balmerovog niza može se provesti pomoću formule dobivene na temelju (15):
Izraz za izračunavanje Planckove konstante može se dobiti transformacijom formule (16):
Gdje m = 9.1 ? 10 -31 kg,e - 1.6 ? 10 -19 Kl,C - 3 ? 10 8 m/S,e 0 =8.8 ? 10 -12 f/ m.
3.2 Zaključakformuleizračunpogreške
Izraz za izračunavanje apsolutne pogreške mjerenja Rydbergove konstante DR može se dobiti diferencirajućom formulom (17). Treba uzeti u obzir da vrijednosti kvantnih brojeva n 1 , n 2 su egzaktni i njihovi diferencijali su nula.
sl.3. Pronalaženje pogreške DC prema rasporedu kalibracije
Veličina apsolutne pogreške u određivanju valne duljine l može se pronaći pomoću kalibracijskog grafikona valne duljine u odnosu na podjelu bubnja l (ts) (vidi sliku 2) . Da biste to učinili, potrebno je procijeniti pogrešku očitanja na bubnju DC i, kao što je prikazano na slici 3, pronađite odgovarajuću pogrešku Dl na zadanoj valnoj duljini.
Međutim, zbog činjenice da vrijednosti ? su vrlo male, onda s postojećim mjerilom grafikona l = f(ts) nije moguće odrediti vrijednost Dl. Zato Dl određuje se s dovoljnom točnošću pomoću formule (24).
Za određivanje Planckove konstante koriste se tablične vrijednosti količina m e, e, e 0, C, koji poznati su s točnošću koja znatno premašuje točnost određivanja Rydbergove konstante, stoga je relativna pogreška u određivanju h bit će jednako:
Gdje DR- pogreška u određivanju Rydbergove konstante.
3.3 Opislaboratorijainstalacije
Izvor svjetlosti, u čijem vidljivom dijelu spektra prevladavaju linije atomskog vodika, je žarulja s tinjajućim pražnjenjem u obliku slova H, napajana visokonaponskim ispravljačem 12. Najveća svjetlina spektra postiže se kada se kraj vodoravni dio cijevi (kapilara) služi kao izvor svjetlosti.
Za mjerenje valnih duljina spektralnih linija u ovom radu koristi se prizmatski monokromator UM-2 (slika 4). Ispred ulaznog proreza monokromatora po optičkoj tračnici na jahačima kreću se vodikova svjetiljka S i kondenzator K koji služi za koncentriranje svjetlosti na ulazni prorez monokromatora (1).
Ulazni utor 1 opremljen je mikrometrijskim vijkom 9, koji vam omogućuje otvaranje utora do željene širine. Kolimatorska leća 2 formira paralelni snop svjetlosti, koji dalje pada na prizmu za raspršivanje 3. Mikrometrijski vijak 8 omogućuje pomicanje leće 2 u odnosu na prorez 1 i služi za fokusiranje monokromatora.
Slika 4. Dijagram laboratorijskih postavki.
Prizma 3 je postavljena na rotacijski stol 6, koji se okreće oko vertikalne osi pomoću vijka 7 s bubnjem za brojanje. Na bubanj se primjenjuje spiralna staza s podjelom stupnjeva. Po stazi klizi pokazivač smjera bubnja 11. Kako se bubanj okreće, prizma se okreće, au središtu vidnog polja teleskopa, koji se sastoji od leće 4 i okulara 5, pojavljuju se različiti dijelovi spektra. . Leća 4 proizvodi sliku ulaznog proreza 1 u svojoj žarišnoj ravnini.
U ovoj ravnini nalazi se pokazivač 10. Za promjenu svjetline osvjetljenja pokazivača postoji regulator i sklopka na monokromatoru.
Slike proreza koje stvaraju različite valne duljine svjetlosti su spektralne linije.
4. NARUDŽBAIZVOĐENJEDJELA
Nakon što pročitate opis laboratorijske instalacije, uključite je sljedećim redoslijedom:
4.1. Okrenite ručku "PRIPREMA" u smjeru kazaljke na satu dok se ne zaustavi, bez primjene pretjerane sile.
4.2. Pritisnite gumb "NA"VISOKO." U ovom trenutku svjetlo će zasvijetliti NETO", strelica instrumenta "TRENUTNOPRAŽNJENJE" odstupiti za 6...8 podjela, doći će do pražnjenja vodikove svjetiljke.
4.3. Koristeći vijke za podešavanje kondenzatora, usmjerite svjetlosnu točku vodikove svjetiljke na nitni križ kapice na ulazu u kolimator, zatim uklonite kapicu.
4.4. Pronađite crvenu, zeleno-plavu, plavu i ljubičastu liniju u spektru vodika. Ovo područje spektra nalazi se otprilike u rasponu od 750...3000 podjela bubnja. Ljubičasta linija je slabog intenziteta. Uz linije atomskog vodika, u spektru vodikove cijevi uočavaju se linije molekularnog vodika u obliku slabih crveno-žutih, zelenih i plavih vrpci. Ne treba ih brkati s jasnim linijama atomskog vodika.
Rotirajući bubanj 7, poravnajte svaku od linija s indikatorom okulara i uzmite broj bubnja prema indikatoru 11.
4.5. Ponovite ovu operaciju tri puta za svaku od četiri linije spektra, prinoseći je pokazivaču okulara s različitih strana. Zabilježite rezultate mjerenja (N 1 ... N 3) u tablicu 1.
4.6. Nakon 10 minuta uređaj će se isključiti, označavajući gašenje zvonom. Ako ga je potrebno ponovno uključiti, ponovite radnje iz paragrafa 4.1 i 4.2. Za isključivanje jedinice u hitnim slučajevima, okrenite gumb "PRIPREMA" u smjeru suprotnom od kazaljke na satu. Izračunajte tablične vrijednosti brojanja bubnjeva za svaku liniju koristeći formule (21…24)
stol 1
IzračuniPorezultatemjerenjarade senaRačunalo
Izračunajte tablične vrijednosti brojanja bubnjeva za svaku liniju koristeći formule (21…24)
Veličina apsolutne pogreške koja se javlja pri mjerenju broja podjela bubnja određena je formulom:
Valna duljina svake linije spektra može se odrediti iz kalibracijskog grafikona monokromatora. Međutim, lakše je to učiniti korištenjem interpolacijske formule:
410,2+5,5493*10 -2 (N prosječno -753,3) 2,060510 -7 (N prosječno - 753,3) 2 +
1,5700 *10 -8 (N prosječno -753,3) 3 (23)
Apsolutna pogreška u određivanju svake od valnih duljina može se izračunati korištenjem interpolacijske formule, prethodno diferenciranom s N CP:
d = 5,5493-10 -2 dNav- 4,121? 10 -7 (N avg - 753,3) dN avg +
4,7112?10 -8 (N c p - 753,3) 3 dN prosječno (24)
Sada možemo početi računati Rydbergovu i Planckovu konstantu pomoću formula (17) odnosno (18). Veličina apsolutne pogreške u određivanju Rydbergove konstante izračunava se pomoću formule (19), a zatim se izračunava relativna pogreška u određivanju Planckove konstante pomoću formule (20).
Dakle, za svaku od spektralnih linija dobivamo vlastite vrijednosti Rydbergove i Planckove konstante, koje bi, strogo govoreći, trebale biti iste za sve te linije. Međutim, kao rezultat pogrešaka u mjerenju valne duljine, te se vrijednosti malo razlikuju jedna od druge.
Za konačni odgovor o vrijednosti konstanti koje se određuju, preporučljivo je postupiti na sljedeći način. Uzmite njihovu prosječnu vrijednost kao vrijednost Rydbergove i Planckove konstante, a uzmite maksimum pogrešaka kao vrijednost apsolutne pogreške u njihovom određivanju. Samo trebate zapamtiti da je vrijednost pogreške zaokružena na prvu značajnu znamenku. Vrijednost konstanti zaokružuje se na brojku istog reda kao i pogreška. Rezultate izračuna unesite u tablicu 2.
Tablica 2.
Na kraju izračuna zapišite rezultate obavljenog rada u obrazac:
R = (R avg ± R)?10 7 1/m
h = (h prosječno ± h)?10 -34 J s
5. KONTROLIRATIPITANJA
5.1. Na kojim se eksperimentalnim činjenicama temelji Bohrov model atoma vodika?
5.2. Navedite Bohrove postavke.
5.3. Što je Balmerova formula?
5.4. Što je Rydbergova konstanta?
5.5. Što je bit Bohrove teorije atoma vodika? Izvedite formulu za polumjer prve i sljedećih Bohrovih orbita elektrona u atomu vodika.
5.6. Izvedite formulu za položaj energetskih razina elektrona u atomu vodika.
5.7. Kakav je energetski spektar atoma vodika? Navedite niz spektralnih linija atoma vodika. Što predstavlja određeni niz spektralnih linija atoma vodika?
KNJIŽEVNOST
I.V. Saveljev. Kolegij opće fizike T.3. ur. M. “Znanost” 1988.
Objavljeno na Allbest.ru
Slični dokumenti
Ideja atoma kao nedjeljivih najmanjih čestica. Rutherfordov eksperiment o raspršenju alfa čestica. Razmatranje linijskog spektra atoma vodika. Bohrova ideja o postojanju stacionarnih stanja u atomima. Opis glavnih eksperimenata Franka i Hertza.
prezentacija, dodano 30.07.2015
Određivanje strukture spektra atoma, molekule ili makrosustava koji oni tvore po njihovim energetskim razinama. Spektri i struktura atoma vodika. Elektronička stanja dvoatomnih molekula, električna i optička svojstva. Molekule s identičnim jezgrama.
kolegij, dodan 06.10.2009
Kinetička energija elektrona. Daybrolove i Comptonove valne duljine. Masa mirovanja elektrona. Udaljenost elektrona od jezgre u nepobuđenom atomu vodika. Vidljivo područje linija spektra atoma vodika. Defekt mase i specifična energija vezanja deuterija.
test, dodan 06/12/2013
Kvantna teorija Comptonovog raspršenja. Smjer gibanja povratnog elektrona. Lagani pritisak. Serijski uzorci u spektrima atoma vodika. Model Thomsona, Rutherforda. Bohrovi postulati. De Brogliejeva hipoteza. Elementi kvantno-mehaničke teorije.
prezentacija, dodano 17.01.2014
Klasifikacija elementarnih čestica. Temeljne interakcije. Rutherfordov model atoma. Bohrova teorija za atom vodika. Atom vodika u kvantnoj mehanici. Kvantno mehaničko utemeljenje periodičkog zakona D. Mendeljejeva. Pojam radioaktivnosti.
sažetak, dodan 21.02.2010
Optička svojstva poluvodiča. Mehanizmi apsorpcije svjetlosti i njihove vrste. Metode određivanja koeficijenta apsorpcije. Primjer izračuna spektralne ovisnosti koeficijenta apsorpcije selektivno apsorbirajuće prevlake u vidljivom i IR dijelu spektra.
sažetak, dodan 01.12.2010
Karakteristike elektrona u stacionarnim stanjima. Uvjet ortogonalnosti sfernih funkcija. Rješenja za radijalnu funkciju. Shema energetskih stanja atoma vodika i serijski uzorci. Ispravci zbog spina elektrona.
prezentacija, dodano 19.02.2014
Princip rada i značajke korištenja svjetlosnih filtara, njihova svrha i glavne funkcije. Tehnika za izdvajanje uskog dijela spektra pomoću kombinacije Schottovih filtara. Redoslijed isticanja jedne ili više linija njihovog spektra, različitih boja i nijansi.
sažetak, dodan 28.09.2009
Priprema monokromatora za rad. Monokromatorska diploma. Promatranje kontinuiranog spektra emisijskih i apsorpcijskih spektara. Mjerenje valne duljine laserskog zračenja. Istraživanje nepoznatog spektra.
laboratorijski rad, dodan 13.03.2007
Proučavanje apsorpcijskih spektara elektromagnetskog zračenja od strane molekula različitih tvari. Osnovni zakoni apsorpcije svjetlosti. Proučavanje metoda molekularne analize: kolorimetrije, fotokolorimetrije i spektrofotometrije. Kolorimetrijsko određivanje nitrita.
Federalna agencija za obrazovanje
TOMSK DRŽAVNO SVEUČILIŠTE SUSTAVA UPRAVLJANJA I RADIO ELEKTRONIKE (TUSUR)
Zavod za fiziku
Laboratorijski rad za kolegij "Opća fizika"
PROUČAVANJE SPEKTRA VODIKOVOG ATOMA
Tomsk 2012
1. SVRHA RADA
Svrha rada je proučavanje emisijskog spektra atoma vodika i eksperimentalno određivanje Rydbergove konstante.
2. OPIS INSTALACIJE I EKSPERIMENTALNIH METODA
Za proučavanje spektra atoma vodika koristi se spektroskop koji se temelji na monokromatoru s prizmom UM-2. Dijagram eksperimentalne postavke prikazan je na slici 2.1.
1 – izvor svjetlosti, 2 – ulazni prorez spektroskopa, 3 – ulazna leća, 4 – složena spektralna prizma, 5 – mikrometarski vijak s bubnjem za brojanje, 6 – ulazna leća, 7 – kazaljka, 8 – okular
Slika 2.1 Dijagram eksperimentalne postavke
Svjetlost iz izvora 1 kroz ulazni prorez 2 i leću 3 pada u paralelnom snopu na spektralnu prizmu visoke disperzije 4. Prizmom se svjetlost razlaže u spektar i kroz leću 6 usmjerava na okular 8. prizma se rotira, različiti dijelovi spektra pojavljuju se u središtu vidnog polja. Prizma se rotira pomoću bubnja 5 na kojem je otisnuta skala u stupnjevima. Okretanjem bubnja spektralna linija se dovodi do strelice pokazivača 7 koja se nalazi u okularu, te se bilježi očitanje na skali bubnja.
Izvor svjetlosti u ovom radu je vodikova cijev s izbojem u plinu i visokotlačna živina žarulja DRSh-250-3.
3. OSNOVNE FORMULE ZA IZRAČUN
Rydbergova konstanta (koeficijent nagiba), izračun prema grafikonu:
 , gdje je (3.1)
, gdje je (3.1)
λ – valna duljina spektralnih linija;
n je glavni kvantni broj.
Pomoćne formule za izračunavanje apsolutne pogreške Rydbergove konstante:
 (3.2)
(3.2)
 (3.3)
(3.3)
 (3.4)
(3.4)
 (3.5)
(3.5)
 (3.6)
(3.6)
Kutni koeficijent pravca k= n*S 3 -S 1 S 2 /D (3.9)
Apsolutna pogreška Rydbergove konstante, kao apsolutna pogreška nagiba pravca k:
 , gdje je (3.10)
, gdje je (3.10)
n – broj bodova.
4. REZULTATI I NJIHOVA ANALIZA.
Tablica 4.1 – Podaci kalibracije spektroskopa za živin spektar
Konstruirajmo kalibracijski graf φ(λ).

Vrijednosti valnih duljina λ vodikovih spektralnih linija određuju se iz kalibracijskog grafikona: vrijednosti φ ucrtavaju se na Y osi, a odgovarajuće vrijednosti na X osi odabiru se tako da se točka poklapa s linijom . Pomoću grafa određujemo valne duljine linija vodikovog spektra. Podatke unosimo u tablicu 4.2.
Tablica 4.2 – Eksperimentalni podaci o spektru atoma vodika
Provjerimo valjanost Balmerove formule. Da biste to učinili, trebate nacrtati ovisnost 1/λ(1/n 2). Izračunavamo potrebne podatke i unosimo ih u tablicu 4.3.
Tablica 4.3 – Podaci za konstruiranje ovisnosti 1/λ(1/n 2)
|
1/, µm 1 |
||||
Nacrtajmo linearnu ovisnost 1/λ(1/n 2)

Iz grafa odredimo Rydbergovu konstantu kao kutni koeficijent linearne ovisnosti 1/λ(1/n 2) prema formuli (3.1).
R= (2,445*10 -6 – 1,517*10 -6)/(0,111–0,028) = 1,108*10 7 (m -1)
Apsolutnu pogrešku R procjenjujemo pomoću formula 3.2 – 3.10.
k= n*S 3 -S 1 S 2 /D=4*0,457-0,241*8,323/0,1623=1,108E+07 m 1

Pogreška u određivanju Rydbergove konstante bila je 0,98%.
Koristeći vrijednosti valne duljine dobivene eksperimentom, konstruirat ćemo fragment energetskog spektra atoma vodika.

Riža. 4.3 Fragment energetskog spektra atoma vodika
Prijelazi uočeni u eksperimentu: 6s → 2p, 5s → 2p, 4s → 2p, 3s → 2p.
Tijekom laboratorijskog rada proučavan je emisijski spektar atoma vodika. Iscrtan je graf linearne ovisnosti 1/λ(1/n 2) iz kojeg je moguće odrediti Rydbergovu konstantu (R). Pogreška u eksperimentalnom određivanju R bila je 1,057E+05 m -1 . Pogreška u određivanju Rydbergove konstante bila je 0,98%.
6. ODGOVORI NA TESTNA PITANJA
KONTROLNA PITANJA ZA LABORATORIJSKI RAD br. 7 “PROUČAVANJE SPEKTRA VODIKOVOG ATOMA”
Objasniti princip rada spektroskopa s prizmom.
Princip rada spektroskopa s prizmom temelji se na fenomenu disperzije svjetlosti.
Što je kalibracija spektroskopa?
Kut otklona zraka monokromatske svjetlosti od prizme nije proporcionalan ni valnoj duljini ni njezinoj frekvenciji. Stoga se disperzivni spektralni uređaji moraju prethodno kalibrirati pomoću standardnih izvora svjetlosti. U ovom laboratorijskom radu referentni izvor svjetlosti bila je živina žarulja.
Matura je bila sljedeća:
Postavite živinu žarulju ispred ulaznog proreza spektroskopa na udaljenosti od 30-40 cm. Uključite napajanje živine lampe pomoću preklopnih prekidača „MREŽA“ i „DRŠ LAMPA“. Upalite živinu lampu pritiskom na tipku “START” nekoliko puta i ostavite da se lampa zagrijava 3-5 minuta. Promjenom širine ulaznog proreza i pomicanjem okulara osigurajte da spektralne linije vidljive kroz okular budu tanke i oštre.
Izmjerite kut rotacije bubnja za različite linije spektra žive, poravnavajući linije u nizu sa strelicom pokazivača u okularu. Linije treba povući prema indikatoru samo s jedne strane kako bi se smanjila pogreška zbog zazora bubnja.
Kako se u kvantnoj mehanici određuje stanje elektrona u atomu vodika?
Odgovarajuće energije E n izvorne funkcije

definiraju stacionarna stanja elektrona u atomu vodika i ovise o kvantnim brojevima n, l I m.
Orbitalni kvantni broj l na određenom n može poprimiti vrijednosti l=0,
1, 2, …, n-1. Magnetski kvantni broj za zadani l uzima vrijednosti  .
.
Što znači kvadrat modula valne funkcije?
Prema tumačenju valne funkcije, kvadrat modula valne funkcije je  daje gustoću vjerojatnosti pronalaženja elektrona na različitim točkama u prostoru.
daje gustoću vjerojatnosti pronalaženja elektrona na različitim točkama u prostoru.
Zapišite stacionarnu Schrödingerovu jednadžbu za elektron u atomu vodika.
 , Gdje
, Gdje
R nl (r) – radijalni dio valne funkcije;
Y lm (θ ,φ) – kutni dio valne funkcije;
n – glavni kvantni broj;
l – orbitalni kvantni broj;
m– magnetski kvantni broj.
Navedite moguća stanja za elektron u atomu vodika sn = 3.
Za n = 3 moguća stanja elektrona u atomu vodika su: s, p, d.
Kako se naziva energija ionizacije atoma vodika?
Država 1 s atom se naziva osnovnim. Odgovara najnižoj energetskoj razini E 1 = -13,6 eV, također se naziva tlo. Sva ostala stanja i energetske razine nazivamo pobuđenima. Veličina | E 1 | je energija ionizacije atoma vodika.
Dokažite da je gustoća vjerojatnosti pronalaska elektrona na udaljenosti jednakaBorovskiradijus je maksimalan.
Vjerojatnost detekcije elektrona u sfernom sloju iz r prije r+
dr jednak volumenu ovog sloja  , pomnoženo s
, pomnoženo s  . Gustoća vjerojatnosti otkrivanja elektrona na daljinu r iz jezgre
. Gustoća vjerojatnosti otkrivanja elektrona na daljinu r iz jezgre

dostiže maksimum na r= r 0 .
Veličina r 0, koji ima dimenziju duljine, podudara se s polumjerom prve Bohrove orbite. Stoga se u kvantnoj mehanici radijus prve Bohrove orbite tumači kao udaljenost od jezgre na kojoj je vjerojatnost pronalaska elektrona najveća.
Koje pravilo odabira poštuje orbitalni kvantni broj i zašto?
Iz zakona održanja kutne količine gibanja tijekom emisije i apsorpcije svjetlosti atoma za orbitalni kvantni broj l javlja se pravilo odabira  .
.
Odredite vrste prijelaza za serijuLymanIpašen.
Za Lymanov niz: np → 1s (n = 2, 3...).
Za Paschenov niz: np → 3s, ns → 3p, nd → 3p, np → 3d, nf → 3d (n = 4, 5 ...)
Pronađite kratkovalnu i dugovalnu granicu (λ 1 Iλ ∞ ) za serijuLyman, Balmer, Paschen.
Za Lymanov niz: m = 1, n = 2, 3, … ∞.
 , R = 1,097 ∙ 10 7 (m -1)
, R = 1,097 ∙ 10 7 (m -1)
za n = ∞.  , λ1 = 1/(1,097 ∙ 10 7) ∙ 10 9 = 91,2 (nm)
, λ1 = 1/(1,097 ∙ 10 7) ∙ 10 9 = 91,2 (nm)
 , λ∞ = 1/(1,097 ∙ 10 7 ∙ 3/4) ∙ 10 9 = 121,5 (nm)
, λ∞ = 1/(1,097 ∙ 10 7 ∙ 3/4) ∙ 10 9 = 121,5 (nm)
Za Balmerov niz: m = 2, n = 3, 4 … ∞.
 , R = 1,097 ∙ 10 7 (m -1)
, R = 1,097 ∙ 10 7 (m -1)
za n = ∞.  , λ1 = 1/(1,097 ∙ 10 7 ∙ 1/4) ∙ 10 9 = 364,6 (nm)
, λ1 = 1/(1,097 ∙ 10 7 ∙ 1/4) ∙ 10 9 = 364,6 (nm)
 , λ∞ = 1/(1,097 ∙ 10 7 ∙ 0,1389) ∙ 10 9 = 656,3 (nm)
, λ∞ = 1/(1,097 ∙ 10 7 ∙ 0,1389) ∙ 10 9 = 656,3 (nm)
Za Paschenov niz: m = 3, n = 4, 5 ... ∞.
 , R = 1,097 ∙ 10 7 (m -1)
, R = 1,097 ∙ 10 7 (m -1)
za n = ∞.  , λ1 = 1/(1,097 ∙ 10 7 ∙ 1/9) ∙ 10 9 = 820,4 (nm)
, λ1 = 1/(1,097 ∙ 10 7 ∙ 1/9) ∙ 10 9 = 820,4 (nm)
 , λ∞ = 1/(1,097 ∙ 10 7 ∙ 0,04861) ∙ 10 9 = 1875,3 (nm)
, λ∞ = 1/(1,097 ∙ 10 7 ∙ 0,04861) ∙ 10 9 = 1875,3 (nm)
7. PRIMJENA
Uz rad je priložena registracijska datoteka (*.REG).
Atomski emisijski spektar vodika je skup linija među kojima se mogu razlikovati tri skupine linija, odnosno serije (sl. 1.13).
Riža. 1.13. Atomski emisijski spektar vodika.
Niz linija u ultraljubičastom području spektra naziva se Lymanov niz. Njegove linije slijede jednadžbu
Bohr je povezao vrijednosti brojeva u tim jednadžbama s "kvantnim brojevima" (rednim brojevima) energetskih razina elektrona u atomu vodika (slika 1.14). Kada je taj elektron u svom osnovnom stanju, njegov kvantni broj u = 1. Svaka linija Lymanove serije odgovara povratku pobuđenog elektrona s jedne od viših energetskih razina u osnovno stanje. Balmerov niz odgovara povratku elektrona s različitih visokih energetskih razina u prvo pobuđeno stanje (na razinu s kvantnim brojem u = 2). Paschenov niz odgovara povratku elektrona na razinu s kvantnim brojem u = 3 (u drugo pobuđeno stanje).
Obratimo pozornost na činjenicu da se linije svake serije postupno približavaju određenoj granici kako se valna duljina smanjuje (vidi sl. 1.13 i 1.14). Valna duljina ove granice konvergencije za svaku seriju određena je odgovarajućom isprekidanom linijom na slikama. Kako se kvantni broj povećava, energetske razine elektrona u atomu vodika postaju sve gušće, približavajući se određenoj granici. Granice konvergencije spektralnog niza odgovaraju prijelazima elektrona koji se nalaze na ovim najvišim energetskim razinama.

Ali što se događa ako elektron dobije još više energije? U tom slučaju, elektron će se moći odvojiti od atoma. Kao rezultat toga, atom će postati ioniziran, pretvarajući se u pozitivno nabijen ion. Energija potrebna za pobuđivanje elektrona kako bi se mogao odvojiti od atoma naziva se energija ionizacije. Vrijednosti energija ionizacije atoma daju važne informacije o njihovoj elektroničkoj strukturi.
LABORATORIJSKI RAD br.18
PROUČAVANJE SPEKTRA VODIKOVOG ATOMA
Cilj rada: proučavanje utjecaja vidljivog, infracrvenog i ultraljubičastog zračenja na tijelo; upoznavanje s tehnikom mjerenja valnih duljina spektralnih linija spektroskopom; proučavanje spektra atoma vodika.
Ciljevi posla: 1) kalibracija spektroskopa prema poznatom spektru živine žarulje; 2) mjerenje valnih duljina linija Balmerove serije atoma vodika; 3) izračun Rydbergove konstante i prvog Bohrovog radijusa.
Potporna sredstva: spektroskop, živine i vodikove žarulje.
TEORIJSKI DIO
Osnove teorije zračenja
Kao rezultat produbljivanja ideja o prirodi svjetlosti, pokazalo se da svjetlost ima dvostruku prirodu, tzv valno-čestični dualitet Sveta. Svjetlost djeluje s nekim objektima kao elektromagnetski val, s drugima poput toka posebnih čestica (kvanti svjetlosti ili fotoni). Odnosno, svjetlost je materijalni objekt koji ima i valna i korpuskularna svojstva. U različitim fizikalnim procesima ta se svojstva mogu manifestirati u različitim stupnjevima. Pod određenim uvjetima, tj. u nizu optičkih pojava, svjetlost pokazuje svoja valna svojstva (npr. pri interferenciji i difrakciji). U tim slučajevima potrebno je svjetlost promatrati kao elektromagnetske valove. U drugim optičkim pojavama (fotoelektrični efekt, Comptonov efekt i dr.) svjetlost pokazuje svoja korpuskularna svojstva i tada je treba prikazati kao struju fotona. Ponekad se optički eksperiment može organizirati na takav način da svjetlost pokazuje i valna i korpuskularna svojstva. Grana fizike koja proučava prirodu svjetlosti, zakone njezina širenja i interakcije s materijom naziva se optika.
Svjetlo je, u užem smislu, isto što i vidljivo zračenje, tj. elektromagnetski valovi u frekvencijskom području koje percipira ljudsko oko (7,5-10 14 -4,3-10 14 Hz , što odgovara valnim duljinama λ u vakuumu od 400 do 760 nm). Unutar tog intervala osjetljivost oka nije ista, već varira ovisno o percipiranoj valnoj duljini zračenja. Oko je najosjetljivije u zelenom području koje odgovara valnoj duljini od oko 550 nm. Svjetlost je - u širem smislu - sinonim optičko zračenje, uključujući, uz vidljivo zračenje, ultraljubičasto UV zračenje (10 nm< λ < 400 нм) и инфракрасной ИК областей спектра (760 нм < λ < 1 мм). Именно в оптическом диапазоне начинают отчётливо проявляться одновременно и волновые и корпускулярные свойства электромагнитного излучения.
Prirodni izvori svjetlosti su Sunce, Mjesec, zvijezde, atmosferska električna pražnjenja itd.; umjetni - uređaji koji pretvaraju energiju bilo koje vrste u energiju vidljivog (ili optičkog) zračenja. Među umjetnim izvorima svjetlosti razlikuju se toplinski izvori, kod kojih se svjetlost javlja kada se tijela zagriju na visoku temperaturu, i luminescentni izvori, kod kojih svjetlost nastaje kao rezultat pretvorbe određenih vrsta energije izravno u optičko zračenje, bez obzira na toplinsko stanje emitirajućeg tijela. Potpuno nova vrsta izvora svjetlosti su laseri (optički kvantni generatori), koji proizvode koherentne svjetlosne zrake visokog intenziteta, izuzetne ujednačenosti frekvencije i oštre usmjerenosti.
Pitanje emisije i apsorpcije svjetlosti od strane materije odnosi se ne samo na optiku, već i na proučavanje strukture same materije (atoma i molekula).
U Rutherfordovim pokusima (1911.) utvrđeno je da se atom bilo kojeg kemijskog elementa sastoji od pozitivno nabijene jezgre, oko koje se nalaze negativno nabijeni elektroni. Općenito, atom je neutralan. Zbirka elektrona čini elektronsku ljusku atoma. Jezgra, u kojoj je koncentrirana gotovo sva masa atoma, zauzima neznatan dio njegovog ukupnog volumena. Promjer jezgre je oko 10 -12 -10 -13 cm. U isto vrijeme, veličina samog atoma, koja je određena veličinom njegove elektronske ljuske, je oko 10 - 8 cm. Rutherfordovi eksperimenti sugerirali su planetarni model atoma, u kojem se elektroni (planete) kreću oko jezgre (Sunca) po zatvorenim (npr. u prvoj aproksimaciji kružnim) orbitama. Ali u ovom slučaju elektroni će se gibati ubrzano, au skladu s klasičnom elektrodinamikom trebali bi kontinuirano emitirati elektromagnetske (svjetlosne) valove. Proces zračenja prati gubitak energije, tako da u konačnici elektroni moraju pasti na jezgru i atom mora prestati postojati. Stoga su pitanja o stabilnosti atoma i obrascima u atomskim spektrima ostala otvorena. (Emisioni ili apsorpcijski spektar je ovisnost intenziteta emisije ili apsorpcije o frekvenciji ili valnoj duljini svjetlosti.)
Analizirajući cijeli skup eksperimentalnih činjenica, danski fizičar Niels Bohr je 1913. godine došao do zaključka da pri opisivanju atoma, odnosno stabilne tvorevine od jezgre i elektrona, treba napustiti mnoge koncepte klasične fizike. Formulirao je postavke koje mora zadovoljiti teorija strukture atoma.
Prvi postulat : atom (elektron u atomu) može biti samo u posebnim stacionarnim ili kvantnim stanjima, od kojih svako odgovara određenoj energijskoj vrijednosti (E 1, E 2,…, E n,….). Dakle, energija atoma (elektrona u atomu) poprima samo diskretne vrijednosti, ili je kvantizirana. U stacionarnim stanjima atom ne zrači.
Drugi postulat (Bohrovo pravilo frekvencije) : Kada atom (elektron u atomu) prijeđe iz jednog stacionarnog stanja s energijom E n u drugo stacionarno stanje s energijom E m, emitira se ili apsorbira kvant svjetlosti (foton) čija je energija jednaka razlici između energije stacionarnih stanja:
E foton = hν nm = E n - E m , (1)
gdje je h = 6,62·10 -34 J×s Planckova konstanta, ν nm frekvencija zračenja (apsorpcije). Ako je E n > E m, tada se emitira svjetlost; ako je E n< E m - поглощение. Формула (1) представляет собой закон сохранения энергии.
Znajući frekvenciju ν nm, možete pronaći valnu duljinu emitiranog (apsorbiranog) elektromagnetskog vala:
gdje je c = 3·10 8 m/s brzina svjetlosti u vakuumu.
Energetske razine atoma i konvencionalni prikaz procesa emisije i apsorpcije svjetlosti (prijelazi E 3 → E 2 odnosno E 1 → E 2) prikazani su na slici 1.
Na temelju predloženih postulata, Bohr je stvorio teoriju najjednostavnijeg atoma vodika i objasnio njegov linijski spektar. Zaključci u Bohrovoj teoriji atoma vodika u potpunosti se podudaraju sa zaključcima moderne kvantne fizike, koja strogo i primjereno opisuje strukturu i spektre atomskih sustava.
U svojoj teoriji, koja trenutno ima samo povijesno značenje, Bohr je razmatrao kretanje elektrona oko jezgre po kružnim orbitama. Utvrdio je da radijusi kružnih orbita koji odgovaraju stacionarnim stanjima atoma r n uzeti diskretne vrijednosti (u SGS e sustavu):
![]() , (3)
, (3)
Ovdje m e– masa elektrona; e– njegova naknada; n– broj orbite (kvantni broj), koji ima vrijednosti 1, 2, 3... itd.
Formula (3) može se napisati na sljedeći način:
Prvi (n = 1) Bohrov radijus, (5)
Rydbergova konstanta, ![]() - konstanta fine strukture.
- konstanta fine strukture.

Valne duljine spektralnih linija emitiranih tijekom kvantnih prijelaza elektrona u atomu vodika određene su Balmerovom formulom:
Ovu je formulu predložio Balmer, koji je proučavao atomske spektre, davno prije stvaranja kvantne mehanike, a kasnije ju je teorijski dobio Bohr. Ovdje su n i m kvantni brojevi (redni brojevi) gornje i donje energetske razine između kojih se događa kvantni prijelaz. Formula (6) jedna je od najtočnijih formula u fizici. Iz toga slijedi da se sve linije emisijskog (apsorpcijskog) spektra atoma vodika mogu spojiti u niz. Niz je skup linija emitiranih tijekom prijelaza elektrona s viših razina s kvantnim brojevima n = m+1, m+2, m+3 itd. na razinu s kvantnim brojem m = const.
Slika 2 prikazuje energetske razine i spektralne serije atoma vodika. Lijevo od razina nalaze se kvantni brojevi koji odgovaraju njihovom rednom broju. Kao rezultat različitih prijelaza atoma vodika s viših razina na niže, nastaju sljedeći nizovi: Lyman (m = 1, n = 2,3,4..); Balmer (m = 2, n = 3,4,5..); Pašen (m = 3, n = 4,5,6..); Brackett (m = 4, n = 5,6,7..); Pfund (m = 5, n = 6,7,8..), itd. Prema formuli (1), frekvencije spektralnih linija proporcionalne su duljinama strelica između energetskih razina kvantnih prijelaza koji se razmatraju. Vidljivo je da najviše frekvencije (kratke valne duljine) odgovaraju linijama Lymanove serije. Lymanova serija u potpunosti leži u ultraljubičastom području spektra elektromagnetskih valova. Sljedeći niz - Balmerov niz (niže frekvencije ili veće valne duljine) već spada u blisko ultraljubičasto i vidljivo područje spektra. Sljedeća serija - Paschen serija (još niže frekvencije) je u bliskom infracrvenom području, a linije preostalih serija su u dalekom infracrvenom području.
Vidljivi dio linijskog spektra atoma vodika (Balmerov niz) sastoji se od niza linija od kojih su najsvjetlije tri: crvena - H a (n = 3), plava - H b (n = 4) , ljubičasta - H g (n = 5).

Mjerenjem valnih duljina ovih linija uzimajući u obzir formulu (6), možemo eksperimentalno pronaći vrijednost Rydbergove konstante R:
R=  (7)
(7)
Primljena vrijednost R omogućuje nam izračunavanje prvog Bohrova radijusa pomoću formule (5) i procjenu linearnih dimenzija atoma vodika ( l~ 2 r 1).
Bohrova teorija, kada je opisivala ponašanje atomskih sustava, nije u potpunosti odbacila zakone klasične fizike. Sačuvala je ideje o orbitalnom gibanju elektrona u Coulombovom polju jezgre (u slučaju atoma vodika, elektron se kreće oko jezgre po kružnim stacionarnim orbitama). Stoga se Bohrova teorija ponekad naziva semiklasičnom. Međutim, odigrala je veliku ulogu u stvaranju atomske fizike. U razdoblju njezina razvoja (1913. - 1925.) došlo se do važnih otkrića, primjerice, u području atomske spektroskopije. No, unatoč uspješnom objašnjenju spektralnih uzoraka atoma sličnih vodiku, koje se podudara sa zaključcima iz kvantne fizike, Bohrova teorija ima niz nedostataka. Konkretno, ne može objasniti spektre emisije složenijih atoma i različite intenzitete spektralnih linija. Ove poteškoće može prevladati samo kvantna teorija, koja uzima u obzir neprimjenjivost klasičnih koncepata na mikroobjekte. U isto vrijeme, Bohrovi postulati u gornjoj formulaciji (bez naznake rotacije elektrona oko jezgre u određenim orbitama) nisu u suprotnosti s konceptima moderne fizike i točno opisuju stacionarna stanja i kvantne prijelaze u atomima.
PRAKTIČNI DIO
Kalibracija spektroskopa
Najjednostavniji optički uređaj za rastavljanje svjetlosti na spektralne komponente i vizualno promatranje spektra je spektroskop. Moderni spektroskopi opremljeni uređajima za mjerenje valnih duljina nazivaju se spektrometri.
Spektroskop korišten u ovom radu (slika 3) sastoji se od cijevi kolimatora (1) i teleskopa (4) postavljenih na postolje (2); staklena prizma (3) ispod poklopca i mikrometrijski vijak (5). Spektralne linije se promatraju kroz okular koji se nalazi na kraju teleskopa.
Shematski dijagram spektroskopa s prizmom prikazan je na slici 4. Ulazni prorez O cijevi kolimatora, osvijetljen svjetlom izvora koji se proučava, emitira uski snop svjetlosti. Ulazni prorez nalazi se u žarištu kolimatorske leće O 1, koja tvori paralelni snop zraka koji padaju na raspršujući element - prizmu. Prolazeći kroz prizmu, svjetlosne zrake se dvaput lome, zbog čega odstupaju od prvobitnog smjera. Zbog ovisnosti indeksa loma prizme o valnoj duljini upadnog zračenja (ta se pojava naziva disperzija), svjetlost složenog spektralnog sastava prizma razlaže na više zraka različitih valnih duljina koje putuju u različitim smjerovima. U tom slučaju zrake kraće valne duljine (ljubičaste) prizma jače odbija od izvornog smjera nego zrake veće valne duljine (crvene). Leća 0 2 teleskopa fokusira ove zrake svjetlosti i stvara obojene linije na različitim točkama žarišne ravnine - slike ulaznog proreza. Ove linije tvore linijski emisijski spektar atoma koji čine izvor svjetlosti koji se proučava. Mjerenjem valnih duljina ovih linija i usporedbom pronađenih vrijednosti s tabličnim podacima o spektrima različitih kemijskih elemenata, možete saznati kojem elementu pripada spektar koji se proučava. Ova tehnika je osnova spektralne analize emisije.

Riža. 3

Rad sa spektroskopom počinje njegovim kalibriranjem. Diplomiranje spektroskopa je proces kojim se uspostavlja veza između očitanja na skali mikrometarskog vijka i valne duljine spektralne linije koja se nalazi nasuprot niti (viziru) u teleskopu. Za kalibraciju se koristi referentni izvor svjetlosti koji ima linije u svim područjima spektra. Valne duljine ovih linija moraju biti poznate s velikom točnošću. Rezultati kalibracije prikazuju se u obliku grafikona, tablica ili kao nova ljestvica.
U ovom radu kao referentni izvor svjetlosti koristi se živina žarulja ultravisokog pritiska tipa SVD-125 ili DRSh. Cijev svjetiljke, izrađena od posebnog kvarcnog stakla i ispunjena živinim parama, propušta svjetlost u vrlo širokom rasponu (uključujući vidljivo i ultraljubičasto područje spektra). Cijev svjetiljke (za zaštitu očiju od ultraljubičastih zraka) smještena je u kućište otporno na svjetlost s malim prozorom za izlazak zračenja.
Uključite živinu svjetiljku pomoću prekidača koji se nalazi na stražnjoj ploči svjetlootpornog kućišta. Lampa bi se trebala zagrijati u roku od 10 minuta. Izlazni prozor upaljene živine žarulje mora se nalaziti nasuprot ulaznog proreza kolimatorske cijevi spektroskopa. Konvencionalne staklene leće i spektroskopska prizma blokiraju ultraljubičasto zračenje, pa će u okularu teleskopa biti vidljive samo pojedinačne spektralne linije različitih boja i intenziteta koje pripadaju vidljivom spektru žive. Promatrajući spektar kroz okular, pomičite živinu lampu kako biste postigli maksimalnu svjetlinu spektralnih linija. Okretanje mikrometarskog vijka uzrokuje rotaciju teleskopa u horizontalnoj ravnini oko vertikalne osi, a nit koja se nalazi u okularu (viziru) pomiče se duž spektra. Preporuča se mjerenje prilikom pomicanja niti od žutih do ljubičastih linija. Poravnajte tražilo sa spektralnom linijom žive. Pomicanjem okulara duž teleskopa, dobit ćete najjasniju sliku ove linije. Ako je potrebno, dodatno zavrnite mikrometarski vijak i ponovno poravnajte nišan s crtom. (Da bi se dobila najtočnija mjerenja, tražilo bi uvijek trebalo prići liniji samo s jedne strane, u našem slučaju - s desne.) Zabilježite očitanje na skali mikrometarskog vijka za odgovarajuću boju u tablici 1. (Jedan puni okret vijak odgovara 50 malih podjela na bubnju. Ako ste dobili 5 punih okretaja i 7 malih podjela - ukupno malih podjela bit će 257.) Valna duljina spektralnih linija žive u tablici dana je u nanometrima (1 nm = 10 -9 m). Izmjerite ostale vodove i ispunite tablicu 1. Ugasite živinu lampu.
stol 1
Na temelju podataka u tablici 1. konstruirajte kalibracijski grafikon (kalibracijska krivulja spektroskopa) na milimetarskom papiru. Valne duljine živinih spektralnih linija ucrtane su duž ordinatne osi OY, a odgovarajuća očitanja na mikrometarskoj navojnoj ljestvici ucrtana su duž apscisne osi OX. Kalibracijski grafikon trebao bi izgledati kao glatka monotona linija. Uz njegovu pomoć, iz izmjerenih vrijednosti položaja (podjela ljestvice mikrovijka) spektralnih linija bilo kojeg drugog zračenja mogu se odrediti njihove valne duljine.
Proučavanje spektra atoma vodika
U ovom radu proučavaju se spektralne linije Balmerove serije atoma vodika, budući da neke od tih linija leže u vidljivom području spektra: crvena - H a, plava - H b, ljubičasta - H g. Za eksperimentalno određivanje Rydbergove konstante potrebno je izmjeriti valne duljine ovih spektralnih linija.
Uključite izvor napajanja vodikove svjetiljke. Postavite izlazni prozor lampe i spektroskopa tako da spektralne linije atoma vodika budu najsvjetlije. Okretanjem mikrometarskog vijka poravnajte nišan okulara s crvenom linijom serije Balmer. Pomicanjem okulara duž teleskopa, dobit ćete najjasniju sliku ove spektralne linije. Zabilježite očitanja skale mikrometarskog vijka u tablicu 2. Izvedite mjerenja za plavu i ljubičastu liniju atoma vodika. Ugasite vodikovu svjetiljku.
tablica 2
U tablicu 2 upiši kvantne brojeve energetskih razina između kojih dolazi do prijelaza uz emisiju odgovarajuće spektralne linije. Odredite valne duljine ovih linija iz kalibracijskog grafikona i pretvorite ih u SI sustav (metri).
Pomoću formule (7) pronađite vrijednost Rydbergove konstante za svaku valnu duljinu. Izračunajte prosječnu vrijednost Rydbergove konstante
i slučajna pogreška povezana s rasipanjem eksperimentalnih podataka: = 0,529 10 -10 m. Izračunajte relativnu pogrešku u određivanju prvog Bohrovog polumjera  .
.
POSTUPAK IZVOĐENJA POSLA
PAŽNJA! U radu se koristi živina lampa, koja je snažan izvor ultraljubičastog zračenja. Ne gledajte izravno u izlazni prozor živine lampe., jer izravno izlaganje svjetlosti očima može izazvati opekline na mrežnici.
1. Upoznajte se sa strukturom spektroskopa.
2. Uključite živinu lampu i zagrijavajte je 10 minuta.
3. Postavite izlazni prozor lampe nasuprot ulaznog prozora kolimatorske cijevi spektroskopa.
4. Pomicanjem živine lampe postići maksimalnu svjetlinu spektralnih linija promatranih kroz okular teleskopa.
5. Okretanjem mikrometarskog vijka, poravnajte ciljnik okulara s prethodno fokusiranom žutom živinom linijom. Zabilježite očitanja skale mikrovijka.
6. Izmjerite ostale živine linije i ispunite tablicu 1. Ugasite živinu lampu.
7. Na temelju podataka u tablici 1. konstruirajte kalibracijski grafikon - ovisnost valne duljine spektralnih linija žive o očitanjima ljestvice mikrometarskog vijka.
8. Upalite vodikovu lampu i postavite je na ulazni prozor spektroskopa.
9. Odredite položaj spektralnih linija Balmerove serije atoma vodika. Unesite očitanja skale mikrometarskog vijka u tablicu 2. Isključite vodikovu lampu.
10. Pomoću kalibracijskog grafa pronađite valne duljine linija H a, H b i H g atoma vodika. Ispunite tablicu 2.
11. Pomoću formule (7) pronađite vrijednost Rydbergove konstante za svaku izmjerenu valnu duljinu.
12. Koristeći formule (8), odnosno (9), izračunajte prosječnu vrijednost Rydbergove konstante i slučajna greška.
14. Nađite relativnu pogrešku u određivanju prvog Bohrovog radijusa  .
.
15. Izvedite zaključak i sastavite izvješće.
KONTROLNA PITANJA
1. Što je svjetlost? Koja svojstva ima? U kojim pokusima su ova svojstva
promatranom?
2. Koja područja spektra elektromagnetskih valova spadaju u pojam optičkog zračenja? Molimo navedite njihove raspone.
3. Kako je ustrojen atom?
4. Formulirajte Bohrove postavke.
5. Kolika je frekvencija emitiranog ili apsorbiranog kvanta svjetlosti?
6. Kako pronaći valnu duljinu svjetlosti?
7. Zapišite Balmerovu formulu. Objasnite sve količine koje su u njemu uključene.
8. Što je prvi Bohrov radijus? Kako procijeniti linearne dimenzije atoma?
1. Saveljev I.V. Tečaj opće fizike. Kvantna optika. Atomska fizika./ M.: Nauka, 1998. - 480 str. (§ 3.1 - § 3.6 str. 51-68)
Povezane informacije.
 Sveučilište Demidov u Jaroslavlju: fakulteti, povijest, komisija za prijem i prolazni bodovi
Sveučilište Demidov u Jaroslavlju: fakulteti, povijest, komisija za prijem i prolazni bodovi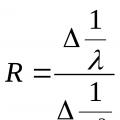 Proučavanje spektra atoma vodika i natrija
Proučavanje spektra atoma vodika i natrija Geografski objekti nazvani po Mendeljejevu
Geografski objekti nazvani po Mendeljejevu